初始會(huì)議審查申請(qǐng)SOP
一�、 目的
規(guī)范臨床試驗(yàn)項(xiàng)目倫理會(huì)議審查申請(qǐng),確保臨床研究的科學(xué)性��。
二����、 范圍
適用于本院開(kāi)展所有臨床試驗(yàn)項(xiàng)目的倫理會(huì)議審查申請(qǐng)。
三��、 標(biāo)準(zhǔn)操作規(guī)程
(一) 電子版資料提交
1. 預(yù)審:預(yù)審資料形式可以是電子版資料����,對(duì)于一些可能需要修改的材料可暫時(shí)不簽字蓋章(對(duì)于不需修改的材料建議按資料清單中的文件形式遞交簽字蓋章版掃描件)。資料清單詳見(jiàn)附件1《首次倫理會(huì)議審查申請(qǐng)?zhí)峤晃募鍐巍?/span>
2. 倫理秘書(shū)核對(duì)無(wú)誤�,郵件回復(fù)同意安排會(huì)審后,上傳所有簽字蓋章版(具體要求見(jiàn)“文件形式”)PDF版至臨床試驗(yàn)機(jī)構(gòu)辦公室(包含上述郵件回復(fù)截圖)����,機(jī)構(gòu)審核無(wú)誤后再遞交紙質(zhì)資料2份(包含上述打印郵件回復(fù))至機(jī)構(gòu)辦公室,由機(jī)構(gòu)辦公室再次核對(duì)紙質(zhì)資料無(wú)誤簽字后轉(zhuǎn)交至倫理秘書(shū)處,倫理秘書(shū)在紙質(zhì)資料上手工簽署同意會(huì)審意見(jiàn)(簽字蓋章后的PDF版本將作為倫理會(huì)議審查資料發(fā)送給各位參會(huì)委員)�。
3. 臨床試驗(yàn)倫理委員會(huì)接收電子版資料郵箱為:hyszxyy_irb@163.com
(二) 紙質(zhì)資料遞交與接收
嚴(yán)格按照附件1《首次倫理會(huì)議審查申請(qǐng)?zhí)峤晃募鍐巍返膬?nèi)容及文件形式遞交,一式兩份��,請(qǐng)用帶分頁(yè)紙��、標(biāo)簽文件夾裝訂并形成文件目錄�����。倫理秘書(shū)核對(duì)無(wú)誤后交主任委員確認(rèn)后簽署同意會(huì)審回執(zhí)(簽字蓋章后的紙質(zhì)資料將主要作為歸檔材料及監(jiān)查��、檢查資料使用)�����。
(三) 倫理審查費(fèi)用
1. 倫理審查費(fèi)以匯款形式交至醫(yī)院財(cái)務(wù)部���,匯款請(qǐng)注明XXX(院內(nèi)財(cái)務(wù)編碼)項(xiàng)目倫理審查費(fèi);
2. 醫(yī)院財(cái)務(wù)科倫理費(fèi)接收賬號(hào)等信息如下:
名 稱:衡陽(yáng)市中心醫(yī)院
賬 號(hào):1905 0220 0902 4903 656
開(kāi) 戶 行:工商銀行衡陽(yáng)城南支行
3. 醫(yī)院財(cái)務(wù)部開(kāi)具正式發(fā)票�,申請(qǐng)者憑繳費(fèi)憑證領(lǐng)取發(fā)票。
4. 具體倫理審查費(fèi)用參照醫(yī)院標(biāo)準(zhǔn)及合同�。
(四) 審批時(shí)間
臨床試驗(yàn)倫理委員會(huì)將擇期安排審查會(huì),從倫理秘書(shū)接受資料到倫理審查一般不超過(guò)一個(gè)月��。
(五) 上會(huì)資料準(zhǔn)備
1. 申請(qǐng)者準(zhǔn)備完整審查紙質(zhì)資料2份(供歸檔使用)。
2. 簡(jiǎn)要審查資料x份(x根據(jù)參加倫理會(huì)議審查的委員人數(shù)確定)��。
3. 確認(rèn)審查匯報(bào)人員并制作匯報(bào)演講幻燈片(在既定會(huì)議審查3個(gè)工作日前提交)�����。
備注:以上資料在既定會(huì)議審查前5個(gè)工作日提交臨床試驗(yàn)倫理委員會(huì)秘書(shū)���,倫理審查流程詳見(jiàn)附件4��。
四�、 附件
附件1 倫理審查申請(qǐng)者向倫理委員會(huì)提供的文件清單
附件2 臨床試驗(yàn)倫理審查申請(qǐng)書(shū)(初始審查)
附件3 衡陽(yáng)市中心醫(yī)院藥物臨床試驗(yàn)首次倫理審批申請(qǐng)表
附件4 倫理審查流程圖
五�����、 關(guān)聯(lián)文件
無(wú)���。
六�����、 制定依據(jù)
1.《藥物臨床試驗(yàn)質(zhì)量管理規(guī)范》���,2020.
2.《涉及人的生物醫(yī)學(xué)審查辦法》 ���,2016.
3.《涉及人的臨床研究倫理審查委員會(huì)建設(shè)指南》,2020.
4.《藥物臨床試驗(yàn)倫理審查工作指導(dǎo)原則》�,2010.
七、 修訂記錄
版本號(hào) | 修訂原因/內(nèi)容 | 修訂后版本號(hào) |
V1.0 | NA | V1.0 |
|
|
|
附件1
首次倫理會(huì)議審查申請(qǐng)?zhí)峤晃募鍐?/span>
首次倫理審查需提交如下材料(以下材料同為遞交機(jī)構(gòu)立項(xiàng)材料����,紙質(zhì)版一式兩份��,請(qǐng)用帶分頁(yè)紙����、標(biāo)簽文件夾裝訂并形成文件目錄)
序號(hào) | 文件名稱 | 文件形式 |
|
1 | 申辦者三證(包括工商、稅務(wù)��、機(jī)構(gòu)代碼三證及試驗(yàn)藥物生產(chǎn)的GMP證書(shū)或證明資料) | 復(fù)印件加蓋所在方公章 |
2 | 研究者手冊(cè)(如適用) | 申辦者/CRO需簽字蓋章�,主要研究者需簽字 |
3 | 試驗(yàn)方案(最新版本) | 申辦者/CRO需簽字蓋章,主要研究者需簽字 |
4 | 知情同意書(shū)(樣表) | 申辦者/CRO需簽字蓋章 |
5 | 主要研究者履歷(包括3年內(nèi)的GCP培訓(xùn)合格證書(shū)) | 主要研究者簽字 |
6 | 主要研究者利益回避及保密聲明 | 主要研究者簽字 |
7 | 組長(zhǎng)單位倫理委員會(huì)批件 | 復(fù)印件加蓋申辦方/CRO公章 |
8 | 國(guó)家局藥物臨床試驗(yàn)批件 《國(guó)家藥品監(jiān)督管理局行政許可文書(shū)受理通知書(shū)》 《開(kāi)展注冊(cè)臨床試驗(yàn)前與CDE溝通交流會(huì)議紀(jì)要或溝通函》 (二選一) | 復(fù)印件加蓋申辦方公章 |
9 | 政府或其他主管部門批件(注冊(cè)類藥物臨床試驗(yàn)必須) | 復(fù)印件加蓋申辦方公章 |
10 | 政府或其他主管部門批件(需進(jìn)行臨床試驗(yàn)審批的第三類醫(yī)療器械臨床試驗(yàn)必須) | 復(fù)印件加蓋申辦方公章 |
11 | CRO��、SMO及其他第三方相關(guān)資質(zhì)證明 | 復(fù)印件加蓋所在方公章 |
12 | 病例報(bào)告表(樣表) | 申辦者/CRO需簽字蓋章 |
13 | 受試者招募材料(如適用) | 申辦者/CRO需簽字蓋章 |
14 | 保險(xiǎn)和/或賠償措施或相關(guān)文件 | 原件 |
15 | 臨床試驗(yàn)立項(xiàng)申請(qǐng)表 | 原件 |
16 | 藥檢報(bào)告/醫(yī)療器械/試劑盒檢測(cè)報(bào)告 | 復(fù)印件加蓋申辦方/CRO公章 |
17 | 申辦單位委托CRO和/或SMO及其他第三方的函 | 原件加蓋申辦方或CRO公章 |
18 | CRA派遣函 | 原件加蓋申辦方或CRO公章 |
19 | 關(guān)于安慰劑使用的說(shuō)明(如適用) | 加蓋申辦方/CRO公章 |
20 | 其他受試者資料(如日志卡����,生活質(zhì)量調(diào)查問(wèn)卷等) |
|
21 | 研究者履歷、GCP證書(shū)及相關(guān)文件 |
|
22 | 設(shè)盲試驗(yàn)的破盲規(guī)程(如適用) |
|
23 | CRC身份證復(fù)印件及派遣函 | SMO蓋章 |
24 | 遞交信 | CRA��、主要研究者簽字 |
25 | 衡陽(yáng)市中心醫(yī)院臨床試驗(yàn)項(xiàng)目機(jī)構(gòu)受理審批表 | CRA需填寫(xiě)表頭及表中“檢查結(jié)果”內(nèi)容 |
26 | 衡陽(yáng)市中心醫(yī)院藥物臨床試驗(yàn)首次倫理審批申請(qǐng)表 | 主要研究者簽字 |
27 | 臨床試驗(yàn)倫理審查申請(qǐng)書(shū) (初始審查) |
|
附件2:
臨床試驗(yàn)倫理審查申請(qǐng)書(shū)(初始審查)
項(xiàng)目基本信息 |
項(xiàng)目名稱 |
|
項(xiàng)目類型 | □注冊(cè)申報(bào)類 □藥物臨床試驗(yàn) 分期 □I □II □III □IV試驗(yàn)藥物名稱: 
□醫(yī)療器械臨床試驗(yàn) 器械類別 □一類 □二類 □三類 試驗(yàn)器械名稱: □體外診斷試劑臨床試驗(yàn) |
□非注冊(cè)申報(bào)類研究(請(qǐng)選擇所有適用的選項(xiàng)) □橫向 □縱向 □其他涉及人的生物醫(yī)學(xué)研究 □研究樣本庫(kù)或數(shù)據(jù)庫(kù)建立 |
研究方法 | □病例報(bào)道 □干預(yù)性試驗(yàn) □觀察性研究(□病例對(duì)照□隊(duì)列 □橫斷面) □定性訪談研究 |
□既有樣本庫(kù)或數(shù)據(jù)庫(kù)分析 □其他 |
性 質(zhì) | □多中心(□國(guó)際□國(guó)內(nèi)) □單中心 |
申辦方/資助單位 |
|
組 長(zhǎng) 單 位 |
|
參 加 單 位 | (可附表) |
承 擔(dān) 科 室 |
|
起 止 日 期 |
|
生 物 學(xué) 標(biāo) 本 采 集 | □是(是否涉及出口、出境 □是 □否) □否 |
標(biāo)本類型(可多選): □血液 □尿液 □組織標(biāo)本 |
□其他請(qǐng)說(shuō)明: |
主要研究者信息 |
姓 名 |
| 職稱 /學(xué) 位 |
|
工 作 單 位 |
| 聯(lián)系電話 |
|
電 子 郵 箱 |
| 通信地址 |
|
主要參加人員情況 |
姓 名 | 學(xué) 位 | 任 職 | 任職機(jī)構(gòu)/部門 | 項(xiàng) 目 分 工 | 簽 名 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
研究摘要 |
研究背景和目的 (100字以內(nèi)) |
|
研究對(duì)照設(shè)置�、干預(yù)措施、觀察指標(biāo)以及隨訪情況 (200字以內(nèi)) |
|
擬采取的招募程序及招募方式 |
□ 健康受試者 □病人(請(qǐng)說(shuō)明) 受試者年齡范圍: 歲 — 歲 受試者性別: □男 □女 受試者是否有弱勢(shì)群體:□是 □否 □精神疾病��、□危重疾病患者�����、□孕婦��、□文盲��、□窮人/無(wú)醫(yī)保者����、□未成年人、 □認(rèn)知損傷者��、 □PI 或研究人員的下屬�����、□研究單位或申辦者的員工���。 (若有�����,請(qǐng)標(biāo)注所涉及的弱勢(shì)群體): 并研究者承諾:若涉及弱勢(shì)群體���,將坦誠(chéng)告知受試者既作為研究者又作為臨床醫(yī)生的雙重角色�,且將強(qiáng)調(diào)研究的自愿性質(zhì)�����,以及拒絕或退出研究的權(quán)利��。 |
數(shù) 量 | (多中心研究項(xiàng)目���,請(qǐng)注明總例數(shù)和本中心承擔(dān)的例數(shù)) |
招募方式 | □ 電子郵件 □ 微信 □手機(jī)短信 □易拉寶 其他: |
是否使用招募材料 | □否 □是 →請(qǐng)作為送審文件一并提交 |
計(jì)劃招募地點(diǎn)(請(qǐng)?zhí)顚?xiě)具體場(chǎng)所,如門診����、病房、社區(qū)等 |
|
獲取知情同意過(guò)程的計(jì)劃安排 |
將以何種形式獲得研究對(duì)象的同意��? □書(shū)面 □口頭(請(qǐng)?zhí)顚?xiě)“免除知情同意簽字申請(qǐng)表”) □電子知情同意 □免除知情同意(請(qǐng)?zhí)顚?xiě)“免除知情同意申請(qǐng)表”) 由誰(shuí)向受試者說(shuō)明研究信息���? 研究者承諾:知情同意應(yīng)符合完全告知����、充分理解、自主選擇的原則��; 知情同意的表述應(yīng)通俗易懂�,適合該受試者群體理解的水平; 計(jì)劃納入不能表達(dá)知情同意者作為受試者時(shí)��,理由充分正當(dāng)����,對(duì)如何獲得知情同意或授權(quán)同意有詳細(xì)說(shuō)明; 在研究過(guò)程中將認(rèn)真聽(tīng)取并耐心詳細(xì)答復(fù)受試者或其代表的疑問(wèn)和意見(jiàn)���; 將給予受試者充分的時(shí)間和機(jī)會(huì)閱讀知情同意書(shū)��、提問(wèn)����、商量和考慮���。 |
研究風(fēng)險(xiǎn) |
是否對(duì)受試者存在潛在傷害 □是 □否 如“是”請(qǐng)簡(jiǎn)要說(shuō)明: 
是否涉及創(chuàng)傷性診療程序□是 □否 如“是”請(qǐng)簡(jiǎn)要說(shuō)明補(bǔ)償方式以及數(shù)量: 
針對(duì)研究風(fēng)險(xiǎn)采取哪些風(fēng)險(xiǎn)防范控制措施��? 是否有獨(dú)立的數(shù)據(jù)安全監(jiān)察委員會(huì)�? □是 如有,請(qǐng)?zhí)峁?shù)據(jù)安全監(jiān)察計(jì)劃 □否 |
研究受益 |
是否給受試者帶來(lái)直接受益��?□是 □否 如“是”���,請(qǐng)說(shuō)明: 是否給社會(huì)帶來(lái)受益���?□是 □否 |
費(fèi)用 |
受試者是否需要支付額外費(fèi)用? □是 □否 |
補(bǔ)償及賠償 |
是否提供補(bǔ)償費(fèi)用�? □是 □否 如“是”請(qǐng)簡(jiǎn)要說(shuō)明補(bǔ)償方式以及金額: 資助方是否提供賠償金? □是 □否 賠償金是否有保險(xiǎn)支持��? □是 □否(若“是”����,請(qǐng)?zhí)峁┍kU(xiǎn)證明) |
主要送審材料 |
研究方案 | 版本號(hào): | 版本日期: |
知情同意書(shū) | 版本號(hào): | 版本日期: |
招募材料 | 版本號(hào): | 版本日期: |
研究者申明 |
本人與該研究項(xiàng)目不存在利益沖突,若在研究開(kāi)展后發(fā)現(xiàn)目前尚未知曉的利益沖突���,我將及時(shí)向倫理委員會(huì)報(bào)告。本項(xiàng)目獲批后���,我將遵循赫爾辛基宣言�����、GCP����、方案以及倫理委員會(huì)的要求,開(kāi)展本項(xiàng)臨床研究����。 |
主要研究者簽名: 日期: |
附件3:
衡陽(yáng)市中心醫(yī)院藥物臨床試驗(yàn)首次倫理審批申請(qǐng)表
衡陽(yáng)市中心醫(yī)院臨床試驗(yàn)倫理委員會(huì):
現(xiàn)有臨床研究項(xiàng)目 申辦方: 提出開(kāi)展臨床研究申請(qǐng),現(xiàn)遞交首次倫理審批資料����,請(qǐng)倫理委員會(huì)審批。
主要研究者:
年 月 日
首次倫理審批遞交資料:
序號(hào) | 文件名稱 | 文件形式 |
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
|
6 |
|
|
7 |
|
|
... |
|
|
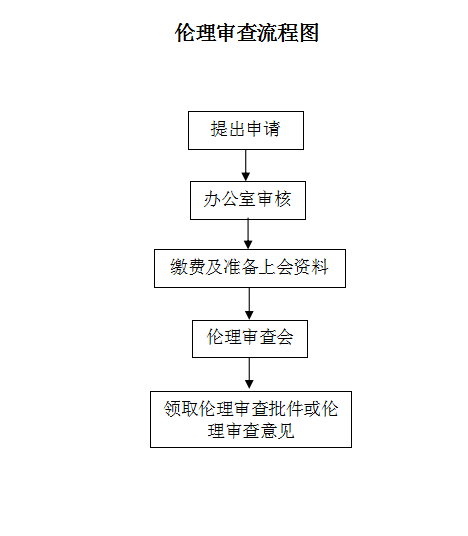
附件4:
倫理審查流程圖